2月17日,eLife杂志在线发表了中国农业大学生物学院于舒洋研究组题为The kinase PDK1 is critical for promoting T follicular helper cell differentiation的研究论文。该论文以PI3K下游蛋白激酶PDK1(serine/threonine kinase 3-phosphoinositide-dependent protein kinase 1)条件敲除小鼠为主,结合多种基因工程小鼠模型的免疫应答分析,阐明了PDK1在TFH细胞分化过程中的功能和相关的分子机制,进一步完善了PI3K通路在Tfh细胞分化中的调控作用。
滤泡辅助性T细胞(T follicular helper cell; Tfh)是一种特殊的CD4+ T细胞亚群,它们能够促进和维持生发中心(germinal center),并能够促使高亲和力的类别转换抗体、长寿命浆细胞和记忆B细胞的形成。因此,Tfh细胞对于长期的体液免疫的成功产生以及对疫苗接种或感染的记忆反应至关重要。尽管已知PI3K介导的信号通路在Tfh细胞的分化过程中发挥着重要作用,但是其精细调控机制还有待进一步完善。

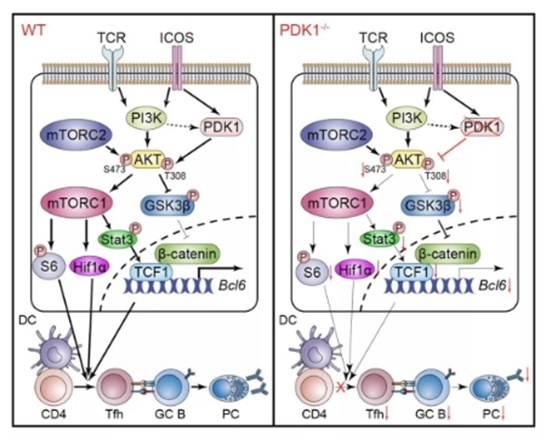
研究发现,无论是急性病毒感染或是蛋白免疫条件下,在T细胞中条件敲除PDK1都会导致小鼠Tfh细胞显著减少并且生发中心反应减弱。进一步通过构建骨髓嵌合体小鼠模型揭示了PDK1对于Tfh细胞的调控是细胞内源性的影响。利用细胞过继模型和定时定点的诱导删除方法,研究人员发现PDK1不仅对于早期Tfh细胞的增殖和分化至关重要,也对晚期Tfh细胞的维持必不可少。机制方面,研究人员发现PDK1调控Tfh细胞分化依赖于上游的ICOS信号。RNA-seq进一步揭示了PDK1缺失后影响Tfh细胞转录谱,一系列与Tfh细胞分化相关的基因均受到明显影响。PDK1缺失后,mTORC1以及下游Hif1α和p-STAT3S727表达下降;同时,PDK1缺失也会导致p-AKTS473以及下游GSK3β活性的下降。这些因素共同导致转录因子TCF1表达量下调,从而进一步削弱Tfh细胞分化。进一步实验证实过表达TCF1以及STAT3-CA(持续激活型)均能够矫正Tfh细胞分化的缺陷。综上研究,揭示了PDK1通过直接和间接调控依赖于mTORC1和mTORC2活性的多个T细胞激活扩展和Tfh细胞的相关基因的表达和磷酸化水平,其中对TCF1表达水平的调节是影响Tfh细胞分化的一个主要调控机制。
中国农业大学生物学院博士研究生孙振、姚英鹏和游孟昊为该论文的共同第一作者;于舒洋教授为该论文的通讯作者。中国医学科学院血液研究所袁卫平研究员提供了实验动物支持和机制研究上的相关思路和宝贵建议。
① 凡本站注明“稿件来源:金宝搏188入口 ”的所有文字、图片和音视频稿件,版权均属本网所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他方式复制发表。已经本站协议授权的媒体、网站,在下载使用时必须注明“稿件来源:金宝搏188入口 ”,违者本站将依法追究责任。
② 本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者在两周内速来电或来函联系。






 金宝搏188入口
金宝搏188入口



